目前纳米载体介导的肿瘤光治疗,特别是具有代表性的光热治疗(PTT)和光动力治疗(PDT)已取得了很大进展。光热治疗肿瘤短期效果好,光动力治疗持续时间较长。但无论是PTT或者PDT都有其不可避免的缺陷,单模式治疗难以彻底根除肿瘤。PTT和PDT协同治疗既继承了光治疗毒性低、副作用小的优点,又能使两种治疗方式取长补短,是提高疗效和减少毒副作用的有效策略。通常PTT和PDT协同治疗的抑瘤率都>95%,但肿瘤的后期复发问题没有得到有效解决。因此,构建一种能降低肿瘤复发率的新型PTT/PDT协同治疗纳米药物体系,对肿瘤后期研究和临床治疗具有重要意义。
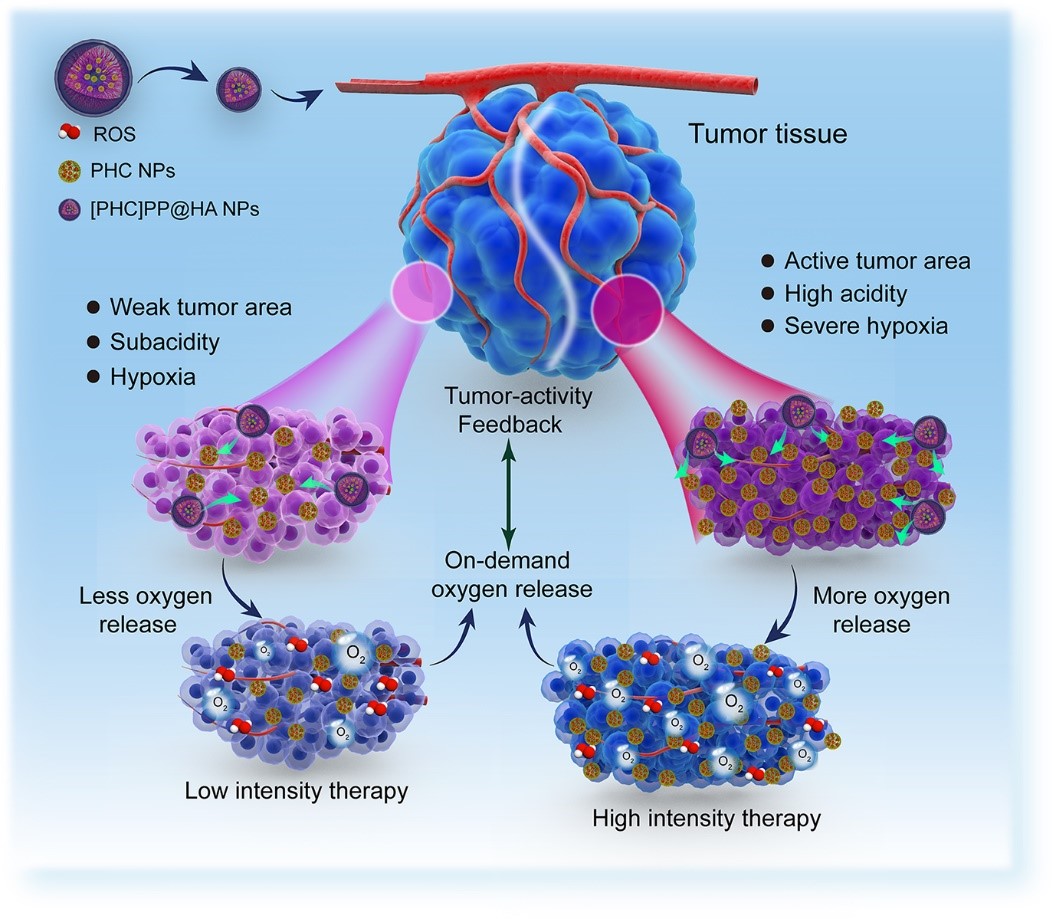
众所周知,肿瘤的后期复发绝大部分原因是前期治疗时没有彻底消除肿瘤细胞。纳米药物在肿瘤内有限的渗透深度和肿瘤内部的严重乏氧状况显著降低了PTT/PDT协同治疗疗效(PDT治疗需要氧气的支持)。近日,西安交通大学生命学院生物医学影像与应用研究所吴道澄教授课题组提出了一种新的PTT/PDT协同治疗肿瘤的策略,在降低肿瘤复发率上取得了显著进展。该研究利用具有良好生物相容性聚多巴胺(PDA)作为载体同时负载血红蛋白(Hb提供氧气)和光敏剂(Ce6)构建小尺寸的纳米颗粒;再将小颗粒包裹进酸敏感PEG-PEI胶束中,表面再修饰能够肿瘤靶向的透明质酸(HA)成为高渗透、酸敏释放复合PTT/PDT协同治疗纳米载体。如图1所示,由于肿瘤的酸性环境,该纳米体系在肿瘤部位释放出具有深度穿透能力的小尺寸聚多巴胺颗粒渗透到肿瘤各个部位,在光照条件下聚多巴胺光热治疗、Ce6释放活性氧光动力协同杀死肿瘤。血红蛋白释放氧气的量根据肿瘤活性调节,肿瘤活性越高的区域酸性越强,血红蛋白释放氧气的量越多,PDT治疗强度也越高,反之亦然。这种根据肿瘤活性调节治疗强度的反馈式治疗策略使得在肿瘤的各个活性区域PTT/PDT协同治疗都能发挥出最大的疗效,肿瘤组织消除更干净,而对正常组织的毒副作用极低。体内抗肿瘤实验显示,该方法不仅对肿瘤的抑瘤率大于98%,而且小鼠60天肿瘤复发率仅为8.3%。
该研究成果日前以“Highly Penetrable and On-Demand Oxygen Release with Tumor Activity Composite Nanosystem for Photothermal/Photodynamic Synergetic Therapy”为题在国际著名学术期刊ACS Nano (IF=15.5)上在线发表,第一作者为西安交通大学生命学院博士生王雅,吴道澄教授为唯一通讯作者,西安交通大学生命学院为该论文的第一和唯一通讯作者单位。该研究成果是吴道澄教授课题组于2019年在光热疗治疗肿瘤复发后(Biomaterials2019, 88;12-23,IF=10.4),在降低肿瘤复发方面又一重要成果。该成果也是博士生王雅继2019年第一作者发表聚多巴胺长循环纳米药物肿瘤治疗体系(Advanced Functional Materials2019, 29(1); 1805582,IF=16.4)后的又一突破性工作。
该工作得到了国家自然科学基金和国家重大科学仪器设备项目的资助。西安交通大学分析测试中心为本工作提供了大量测试表征支持。
论文链接:https://pubs.acs.org/doi/10.1021/acsnano.0c06415